La
reacción entre un iluro de azufre y un aldehído o cetona produce un
oxaciclopropano.
El
mecanismo de esta reacción consiste en el ataque del carbono polarizado
negativamente del iluro al grupo carbonilo. El resultado del ataque es una sal
de azufre que se cicla dando un oxaciclopropano, mediante un mecanismo de
sustitución bimolecular, aprovechando que el azufre positivo es muy buen grupo
saliente.
Preparación del iluro de azufre
La
preparación del iluro de azufre se hace a partir de haloalcanos en dos etapas:
la primera consiste en una sustitución nucleófila con sulfuro de dimetilo, la
segunda consiste en la desprotonación del carbono contiguo al azufre mediante
bases como butillitio.
FLORUROS Y RADICALES
Los
fluoruros suelen ser elementos incoloros (si no están unidos a un grupo
coloreado). Los fluoruros de los metales alcalinos son solubles en agua e higroscópicos,
mientras que los fluoruros de los elementos alcalinotérreos, especialmente del calcio y del bario, son poco solubles.
El fluoruro de calcio se encuentra en la naturaleza como fluorita
(de este mineral han recibido su nombre el elemento y los fluoruros), el
principal mineral
de este elemento. El difluoruro de oxígeno (OF2) es
el único compuesto con el oxígeno en el estado de oxidación +2.
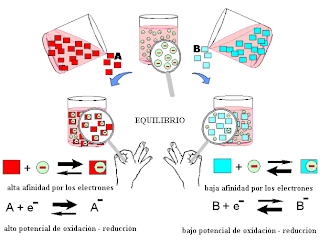
El
fluoruro no puede ser oxidado por otros elementos o compuestos a flúor elemental,
por ello los fluoruros pueden estabilizar los números de oxidación más elevados
de los elementos.
Los
compuestos fluoruros exterminan todos los microorganismos del sistema
digestivo. A largo plazo pueden causar problemas digestivos y ciertos problemas
con el colon.
En
química,
un radical (antes referido como radical libre) es una especie
química (orgánica o inorgánica), en general es extremadamente inestable y, por tanto, con gran poder reactivo por poseer un electrón desapareado.1
En
la Nomenclatura
de los compuestos orgánicos, un radical orgánico es un sustituyente,
como un grupo alquilo, que son partes de una molécula,
sin existencia aislada, representada por R- en la fórmula de los compuestos orgánicos.
Poseen
existencia independiente aunque tengan vidas medias muy breves, por lo que se
pueden sintetizar en el laboratorio, se pueden formar en la atmósfera
por radiación,
y también se forman en los organismos vivos (incluido el cuerpo humano) por el
contacto con el oxígeno y actúan alterando las membranas
celulares y atacando el material genético de las células, como el ADN.
Los
radicales tienen una configuración electrónica de capas abiertas por lo que
llevan al menos un electrón desapareado que es muy
susceptible de crear un enlace
con otro átomo o átomos de una molécula. Desempeñan una función importante en
la combustión,
en la polimerización, en la química atmosférica, dentro de las células y en
otros procesos químicos.
Para
escribir las ecuaciones químicas, los radicales frecuentemente se escriben
poniendo un punto (que indica el electrón impar) situado inmediatamente a la
derecha del símbolo atómico o de la fórmula molecular como:
H2 + hν → 2 H· (reacción 1)